
【Cell】人类衰老机制研究领域重大进展:美国科学院院士袁钧瑛团队再次发力
衰老是遗传性和散发性神经退行性疾病的主要危险因素。然而,尚不清楚衰老如何与遗传易感基因相互作用以促进神经变性。8月23日,来自哈佛医学院/中科院生物与化学交叉研究中心袁钧瑛教授课题组的研究成果在Cell上发表,该研究运用一系列实验证据阐明了致病突变基因TBK1、衰老调控基因TAK1以及调控细胞死亡的基因RIPK1在神经退行性疾病产生过程中的协同作用的调控机制,对深入理解衰老与神经退行性疾病的发生具有重大的启示。
该研究还显示TBK1是RIPK1的内源性抑制剂,并且Tbk1 - / - 小鼠的胚胎致死性依赖于RIPK1激酶活性。在衰老的人类大脑中,另一种内源性RIPK1抑制剂TAK1表现出显著的降低。该研究显示在Tbk1 +/-小鼠中,减少的髓样TAK1表达促进ALS / FTD的所有关键标志,包括神经炎症,TDP-43聚集,轴突变性,神经元丢失和行为缺陷,其在抑制RIPK1时被阻断。因此,衰老通过减少TAK1表达促进RIPK1活化,TAK1表达与遗传风险因子协同作用以促进ALS / FTD的发作。
TBK1通过介导干扰素调节因子(IRF)3的激活在抗病毒先天免疫中起关键作用,导致I型干扰素(IFN-α/β)的诱导。 多种病毒已经进化出精心策略,通过靶向TBK1来逃避抗病毒反应。 因此,TBK1的病毒抑制可能提供敏感的背景,如TBK1杂合性,在衰老的大脑中促进神经炎症和神经变性。 总之,研究结果表明,在遗传或环境压力的情况下,大脑中RIPK1抑制的年龄依赖性减少可能易于神经炎症和神经变性。
原文链接:
https://www.cell.com/cell/fulltext/S0092-8674(18)30969-3#
Xu et al., 2018, Cell 174, 1–15
September 6, 2018©2018 Elsevier Inc.
https://doi.org/10.1016/j.cell.2018.07.041
研究团队介绍
袁钧瑛(美国科学院院士,美国哈佛大学医学院终生教授、美国艺术与科学学院院士,美国科学促进会会士、国家“顶尖千人计划”入选者)是细胞凋亡研究领域最杰出的开拓者之一,是世界上第一个细胞凋亡基因的发现者。她对阐明凋亡和坏死等多种细胞死亡形式的分子调控机制以及其在癌症和神经退行性疾病中的意义作出了重要的贡献。由其领衔,依托上海有机所和上海药物所的“中国科学院生物与化学交叉研究中心”,以人类健康前沿研究领域中的神经系统疾病,如阿尔茨海默氏病、帕金森氏病、肌萎缩性脊髓侧索硬化症等与衰老相关的神经退行性疾病以及神经损伤和修复为核心,发展和运用最前沿的生物与化学技术手段对人类神经系统病变特别是神经退行性疾病中共性和关键性的科学问题开展研究。相关研究成果对阐明凋亡和坏死等多种细胞死亡形式的分子机制以及其在癌症和神经退行性疾病中的作用具有重要意义,将为人类健康事业做出卓越贡献,为国家产业转型升级提供强有力的智力支撑。
百凌生物定制抗体助力生命科学前沿研究!
由百凌生物根据本研究团队特定要求所合作定制开发的p-RIPK1(S166)重组单克隆抗体(克隆号:YJY-1-5)能特异性识别RIPK1蛋白第166位丝氨酸的磷酸化修饰,适用于WB、IP、IHC等应用。
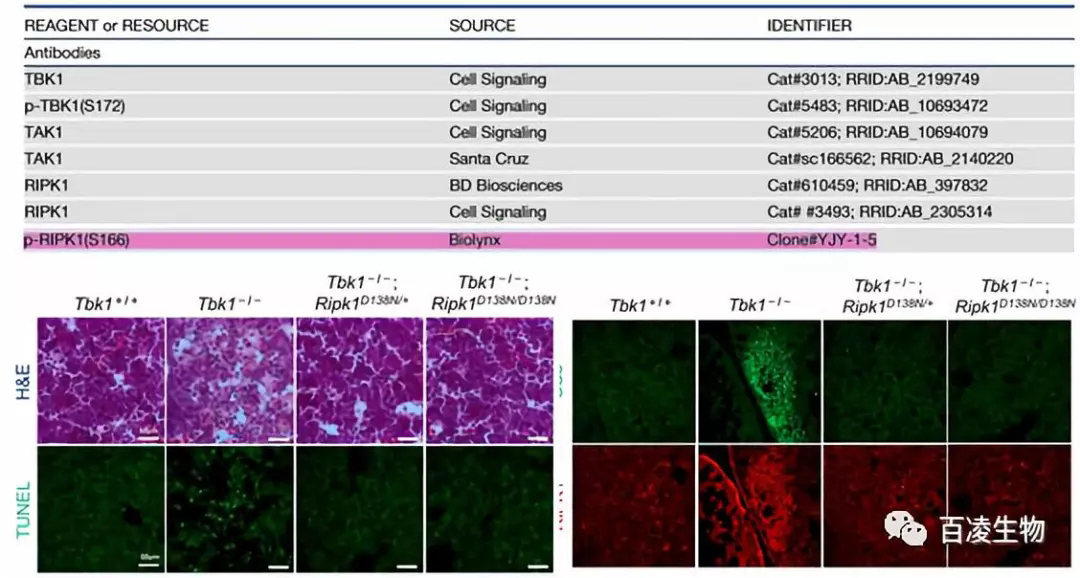
|
图片来源:Xu et al., 2018, Cell 174, 1–15 |
|
|